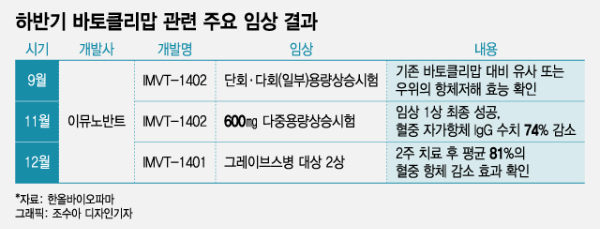
25일 한올바이오파마에 따르면 이 회사의 미국 파트너사인 이뮤노반트는 지난 20일(미국 시간) 그레이브병 환자를 대상으로 한 'IMVT-1401'(성분명: 바토클리맙)이 미국 미상 2상에 유효성 확보에 성공했다. 한올바이오파마는 지난 2017년 이뮤노반트에 바토클리맙을 기술수출한 바 있다. 임상을 진행 중인 이뮤노반트는 바토클리맙의 미국과 유럽 판권 등을 보유 중이다.
각각 12주·24주차에 결과를 측정했으며, 다른 적응증을 대상으로 진행된 연구 결과와 일관되게 고용량(680㎎)에서 최대 87%의 혈중 항체 감소 효과를 보였다. 또 12주 치료 후 평균 81%의 혈중 항체 감소 효과를 나타냈다. 기존 항갑상선 치료제의 용량 변화없이 바토클리맙을 투여받은 환자군에서 50% 이상의 치료 반응률을 나타냈다. 임상 기간 관찰된 새롭게 관찰된 이상반응은 없었다.
특히 지난 19일(미국시간) 경쟁사로 꼽히는 아제넥스의 '비브가르트' SC제형의 천포창(피부·점막에 물집이 생기는 자가면역질환) 3상 실패에 IMVT-1401 임상 결과가 더욱 주목 받는 분위기다. 비브가트 역시 FcRn을 타깃으로 하는 자가면역질환 치료제다. IMVT-1401은 천포창 대상 치료제로 개발 중이진 않다. 다만 현재 두 회사 모두 각사 물질의 임상 연구를 통한 적응증 확대에 주력하고 있는 만큼, 반사이익을 얻었다는 평가다.
한올바이오파마가 경쟁사와 엇갈린 임상 결과에 웃은 것은 이번이 처음은 아니다. 이뮤노반트는 지난달 말 자가면역질환 치료제로 개발 중인 'IMVT-1402'의 임상 1상 고용량 시험에서 약물의 안전성을 확인했다. 건강한 성인 대상 4주 반복 투약에서 혈중 자가 항체 lgG 수치를 74% 줄인 것이 골자다. 반면, 같은 날 비브가르트의 면역혈소판감소증 임상 3상은 경쟁력을 입증하는 데 실패했다.
이 시각 인기 뉴스
올해 바토클리맙 가치 증명을 위한 주요 과제는 IMVT-1402의 안정성 확보였다. IMVT-1402는 이뮤노반트가 IMVT-1401의 부작용을 보완한 후속 물질로 근간은 같은 물질이다. 바토클리맙과 관련된 모든 후속 임상의 열쇠를 IMVT-1402가 쥐고 있던 셈이다. 결국 바토클리맙과 관련된 하반기 주요 임상들이 성공적 결과를 도출함에 따라 내년 미국 후속 임상도 탄력을 받게 됐다.
이뮤노반트는 이번 임상 데이터를 바탕으로 IMVT-1402의 개발 계획을 내년 확정하기로 했다. 현재까진 무난히 그레이브스병 임상 2상에 돌입할 것이란 분석에 무게가 실린다. 또 상반기 다발성신경병증 2상과 하반기 중증근무력증 3상 탑라인 데이터 공개가 예정돼 있다. 대표적 자가면역질환 중 하나인 류마티스 관절염 임상 2상도 연내 개시가 전망된다.
엄민용 현대차증권 연구원은 보고서를 통해 "올해 발표 예정이었던 임상 결과를 약속했던 시기에 신뢰성 높게 발표했다"며 "특히 그레이브스병 관련 임상 결과는 아제넥스가 타깃하지 못하고 이뮤노반트만 타깃하고 있는 여러 적응증(류마티스관절염, 전신홍반성루프스, 그레이브스병, 섬유근육통, 근염, 루프스신염, 혈관염 등) 중 처음으로 유효성을 보여준 결과라는 점에 의미가 있다"고 말했다.
중국에선 바토클리맙을 활용한 중증근무력증 치료제 허가신청도 이뤄질 전망이다. 한올바이오의 중국 파트너사 하버바이오메드는 지난 3월 현지 임상 3상에서 HBM9161'의 우호적 탑라인(핵심지표) 데이터를 확보한 뒤, 6월 현지 국가약품감독관리국(NMPA)에 신약승인신청서(BLA)를 제출한 바 있다. 하지만 지난 1일 허가당국과의 상의 후 자발적으로 3상 연장 기간 데이터를 포함해 재신청하기로 결정했다. 단순 기간 연장만 이뤄지는 만큼 추가 환자 모집은 없으며, 내년 상반기 BLA를 다시 제출한다는 계획이다.
