7일 제약업계에 따르면 유한양행은 다음 달 2~4일 싱가포르에서 열리는 '유럽종양학회(ESMO) 아시아'에서 렉라자 단독요법 1차 치료제 임상 3상 주요 결과를 발표할 예정이다. 학회 둘째 날인 다음 달 3일 해당 임상을 이끌고 있는 조병철 연세의대 내과학교수가 렉라자의 임상 3상 결과를 발표할 것으로 보인다.
당시 조병철 교수는 "레이저티닙은 전세계 EGFR 돌연변이 양성 비소세포폐암 환자들에게 새로운 1차 치료 옵션이 될 수 있을 것"이라며 "상세한 임상시험 결과는 12월내 전문 학회를 통해 상세히 공개될 예정"이라고 말했다.
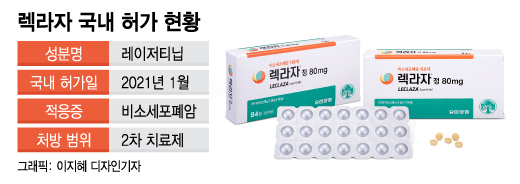
다음달 공개되는 구체적 임상 결과가 긍정적일 경우 렉라자가 1차 치료제로 허가될 수 있는 길이 열리게 된다. 지난해 1월 식품의약품안전처로부터 국내에서 31번째로 개발된 신약으로 허가받은 렉라자는 현재 2차 치료제로만 처방된다. 유한양행은 임상 3상 결과를 바탕으로 내년 식약처에 1차 치료제로 적응증을 확대하는 품목허가 변경을 신청한다는 계획이다.
국내 폐암 1차 치료제 시장 규모는 2차 치료제 시장의 3배다. 2차 치료제 시장이 1000억원인 반면 1차 치료제는 3000억원이라는 것이 업계 추산이다. 이번 임상 3상을 발판으로 렉라자가 1차 치료제로 도약하면 그만큼 공략 가능한 시장 범위가 넓어지는 셈이다.
이 시각 인기 뉴스
현재 국내 1차 치료제 시장의 강자는 해당 시장의 3분의 1 이상을 차지한 아스트라제네카의 타그리소다. 렉라자가 1차 치료제 시장에 진입하게 되면 타그리소의 아성을 넘어야 하는데 해볼만 한 경쟁이라는 전망도 나온다. 타그리소는 1차 치료제로서 현재 건강보험 급여 적용을 받지 못해 환자 부담 비용이 크기 때문이다.
한 업계 관계자는 "타그리소의 글로벌 임상에서 아시아인에 대한 결과가 좋지 못했던게 급여 적용을 받지 못한 배경"이라며 "한국인 임상데이터를 다수 보유한 렉라자가 1차 치료제로 허가받게 되면 국내 시장에서 타그리소대비 처방 우위를 차지할 수도 있다"고 말했다
이호철 하이투자증권 연구원은 "이번에 공개되는 임상 3상의 세부 결과를 근거로 1차 치료제 허가 및 보험급여 적용을 받게되면 렉라자는 1000 억원 이상의 연매출을 달성할 것으로 기대된다"고 말했다.
