 자폐 스펙트럼 장애를 가진 주인공이 나오는 드라마 '이상한 변호사 우영우'. / 사진=KT
자폐 스펙트럼 장애를 가진 주인공이 나오는 드라마 '이상한 변호사 우영우'. / 사진=KT김은준 기초과학연구원(IBS) 시냅스 뇌질환 연구단장은 21일 관련 온라인 브리핑을 열고 "자폐 치료를 위해선 유년기 조기 진단이 무엇보다 중요하다"며 이같이 밝혔다. 유년기 자폐 치료 중요성을 다룬 연구 논문 두 편은 최근 국제학술지 '네이처 커뮤니케이션즈'와 '셀 리포츠'에 게재됐다. 최상위 학술지에 비슷한 시기 논문이 게재된 건 연구 혁신성을 인정받았다는 의미다.
김은준 단장 연구팀은 이를 파악하기 위해 IBS 뇌과학 이미징 연구단, 배용철 경북대 교수 연구팀과 공동 연구를 진행했다. 특히 유년기 자폐 증상이 성장 과정에서 어떻게 달라지는지 분석했다. 마우스를 대상으로 'MYT1L' 유전자를 제거해 자폐 증상을 만들고 뇌 변화를 관측했다.
실험 대상 생쥐의 자폐 증상은 청소년기 일시적으로 정상화됐지만 다 자란 성체기에는 다시 강하게 나타났다. 유년기와 성체기 모두 자폐 증상이 나타났지만 시냅스 매커니즘은 달랐다. 유년기는 흥분성 시냅스가 현격히 줄었다면, 성체기는 억제성 시냅스의 수와 신호 전달이 급격히 증가해 균형이 깨졌다. 이는 유년기 뇌 변화가 청소년기를 지나 성체기 직전까지 자폐 증상을 유발한다는 의미다.
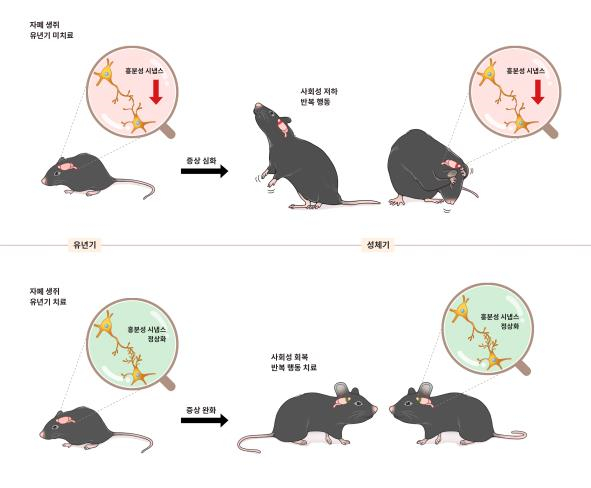 유년기 치료 여부에 따른 성체기 자폐 증상 발현을 보여주는 그림. 흥분성 시냅스의 수와 기능에 이상이 생기면 자폐 증상이 유발된다. 연구진은 유년기에 집중적인 약물치료를 진행하면 사회성 저하와 반복 행동 등 자폐의 대표적인 증상이 성체기까지도 완화된다는 사실을 동물실험으로 입증했다. / 사진제공=기초과학연구원(IBS)
유년기 치료 여부에 따른 성체기 자폐 증상 발현을 보여주는 그림. 흥분성 시냅스의 수와 기능에 이상이 생기면 자폐 증상이 유발된다. 연구진은 유년기에 집중적인 약물치료를 진행하면 사회성 저하와 반복 행동 등 자폐의 대표적인 증상이 성체기까지도 완화된다는 사실을 동물실험으로 입증했다. / 사진제공=기초과학연구원(IBS)이 시각 인기 뉴스
자폐 증상, 유년기가 치료 골든타임
연구팀은 이 같은 연구 결과를 바탕으로 또 다른 자폐 모델 마우스에서 조기 치료의 효과를 검증했다. 이번에는 자폐 증상을 만들기 위해'ARID1B' 단백질이 없거나 불완전한 생쥐를 만들어 유전자를 집중 분석했다.
그 결과, 유년기 ARID1B 단백질 결손이 뇌 전전두엽의 흥분성 시냅스 수를 감소시켰다. 이는 청소년기와 성체기 생쥐의 흥분성 시냅스 기능 감소로까지 이어졌다. MYT1L 유전자가 없는 생쥐와 달리, ARID1B 단백질 결손 생쥐는 성체기까지 자폐 증상이 이어졌다.
연구팀은 마우스에 흥분성 시냅스를 항진시키는 약물인 '플루옥세틴'(Fluoxetine)을 생후 3주 동안 투여했다. 결과적으로 유년기 약물치료를 받은 돌연변이 생쥐는 성체가 돼도 정상 생쥐와 유사한 수준의 사회성과 반복 행동을 보이는 사실을 확인했다. 시냅스의 신호 전달과 수 역시 정상화됐다.
김은준 단장은 "두 건의 연구를 통해 성장 과정에 따른 자폐 발생 메커니즘을 규명하고, 유년기의 집중 치료 후 추가로 약물을 투여하지 않아도 평생 자폐 증상이 완화될 수 있음을 확인했다"며 "다른 유전자에 의해 유발되는 자폐 증상 역시 유년기 진단과 약물 치료로 완화할 수 있는지 후속 검증 연구를 진행하겠다"고 밝혔다.
