29일 제약·바이오업계에 따르면 FDA가 한미약품과 파트너사 스펙트럼에 통보한 롤론티스 승인심사 기한은 다음달 9일 까지다. 기한이 한국 시간으로 다음주 추석까지인 셈이다. 한 업계 관계자는 "이르면 다음 주 중 허가 여부가 통보될 것으로 보인다"고 말했다.
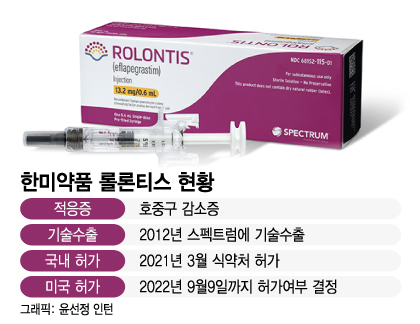
한미약품은 2012년 스펙트럼에 롤론티스의 글로벌 개발 및 판매 권리(한국, 중국, 일본 제외)를 수출했다. 미국 임상과 허가는 스펙트럼이 주도하지만 원 개발사인 한미약품과 사실상 공동 대응 중이다. 한미약품이 평택 바이오플랜트에서 생산을 담당하는데다 롤론티스 허가 후 판매 수익 중 일부를 계약조건에 따라 마일스톤(단계별 기술료)과 로열티(경상기술료)로 받게 돼서다.
한미약품과 스펙트럼은 롤론티스 허가 승인 후 시판을 위한 준비까지 마쳤다. 롤론티스의 미국 제품명을 'ROLVEDON(롤베돈)'으로 확정했고 미국 내 영업·마케팅 인력도 충원했다.
사실 이번 승인심사는 롤론티스와 한미약품, 스펙트럼엔 세 번째 도전이다. 스펙트럼은 2018년 FDA에 롤론티스의 품목허가(BLA) 신청을 했다가 추가 자료 보완을 위해 신청을 자진 취하했고 이듬해 재도전했지만 코로나 팬데믹으로 실사가 지연되다 지난해 FDA로부터 생산시설에 대한 재실사가 필요하다는 보완요구서(CRL)를 받았다. 올해 3월 세 번째 BLA를 제출했고 이에 대한 FDA의 답이 다음달 9일까지 나오는 것이다.
이 시각 인기 뉴스
이번에 허가를 받으면 2년 반 만에 국산 신약이 세계에서 허가 조건이 가장 까다로운 FDA의 문을 넘게 된다. 마지막으로 FDA 허가를 받은 국산 신약은 2019년 11월 승인된 SK바이오팜의 뇌전증 신약 엑스코프리였다. 지금까지 엑스코프리를 포함해 FDA에서 허가받은 국산 의약품은 5개에 불과하다. 롤론티스가 6번째 FDA 허가 국산 신약이 되는 것이다.
판매 효과도 막대할 것으로 보인다. 전 세계 호중구감소증 치료제 시장은 8조원에 육박하는데 이 가운데 미국 시장 규모만 절반에 가까운 3조원 이상이다. 허가 후 롤론티스가 현지 시장에 안착할 경우, 매출은 스펙트럼이 가져가지만 계약을 통해 한미약품이 받을 로열티 규모도 상당할 것으로 예측된다. 미래에셋증권은 로열티를 13%로 가정할 경우 롤론티스가 한미약품에서 가질 가치를 3910억원으로 추정했다.
때문에 글로벌 경쟁사도 롤론티스의 허가 여부에 촉각을 곤두세운다. 호중구감소증 치료제의 선도 의약품은 세계 바이오산업의 대명사격인 미국 암젠이 개발한 '뉴라스타'다. 암젠은 FDA에 롤론티스 허가심사 관련 자료 정보공개를 요청하기도 했다. 공정과 테스트 등 롤론티스 관련 세부적 문제를 파악하기 위해서였던 것으로 보인다는데 업계 분석이었다. 암젠으로서는 롤론티스가 뉴라스타의 잠재적 시장 경쟁자이기 때문이다.
게다가 롤론티스는 뉴라스타 시장을 파고들 경쟁력도 갖춘 것으로 분석된다. 한미약품은 롤론티스에 체내 의약품 약효 지속시간을 늘려주는 플랫폼 기술 '랩스커버리'를 적용해 약효지속기간을 3주로 늘렸다. 롤론티스가 주 1회 투여하는 뉴라스타와 차별화 되는 부분이다. 이 기술을 바탕으로 적은 용량으로도 뉴라스타와 비슷한 약효 지속성을 낼 수도 있다.
한 업계 관계자는 "앞서 보완 요청을 받은 롤론티스 공장 실사가 잘 마무리됐는지가 이번 허가의 관건"이라고 말했다. 지난 달 FDA 관계자들이 한미약품의 평택 바이오플랜트를 방문해 롤론티스 허가를 위한 실사를 마친 상태다. 이 실사 결과를 바탕으로 FDA는 최종 허가 여부를 결정하게 된다. 한미약품 관계자는 "롤론티스는 한미약품이 출시하는 첫번째 글로벌신약이라는 점에서 의미가 크다"며 "미국에서만 약 3조원대 시장을 형성하고 있는 호중구감소증 치료제 분야에서 반드시 실질적 성과를 창출할 수 있도록 그룹 역량을 집중시키겠다"고 말했다.
