
24일 업계에 따르면 FDA는 최근 CAR-T 치료제 제조사들에 서한을 보내 'T세포 악성종양' 부작용 가능성을 제품 설명서에 추가하도록 요구했다. 부작용 문구가 추가되는 6종 CAR-T 제품은 △노바티스의 '킴리아' △존슨앤드존슨의 '카빅티' △BMS의 '브레얀지'·'아벡마' △길리어드사이언스의 '예스카타'·'테카투스'이다.
FDA 요구에 따라 각 제약사는 30일 이내에 제품 라벨(label)에 부작용 경고를 추가해야 한다. 구체적인 문구는 "BCMA 및 CD19 유전자 변형 자가 T세포 면역요법 치료 후에 T세포 악성종양이 발생할 수 있음"이다. 제약사들은 이번 조치에 반박하는 설명서를 대신 제출할 수도 있지만 대체로 FDA 지시에 따르며 문구 변경을 준비 중인 것으로 알려졌다.
문제가 된 6종 제품 중에서 노바티스의 킴리아와 존슨앤드존슨의 카빅티가 국내에서 허가됐다. 킴리아는 상급종합병원 위주로 이미 여러 차례 처방됐다. 지난 22일 가톨릭대학교 여의도성모병원이 킴리아의 처방 시작을 홍보하는 등 가장 최근까지도 국내 도입이 이뤄지고 있다. 투약 비용은 3억6000만원이다. 건강보험이 적용돼 환자는 최대 약 600만원만 내면 된다.
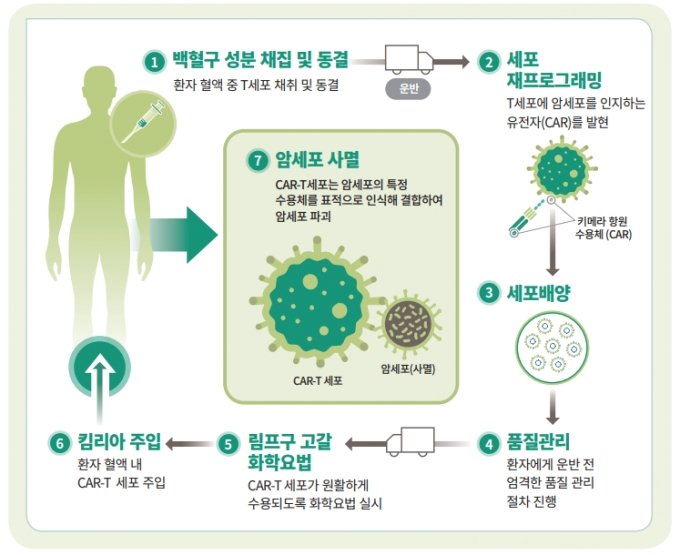 CAR-T 치료제 킴리아의 제조, 처방 과정/사진제공=한국노바티스
CAR-T 치료제 킴리아의 제조, 처방 과정/사진제공=한국노바티스이번 안전성 이슈가 업계와 의료계에 미치는 영향은 크지 않을 것으로 보인다. 노바티스와 BMS 등 CAR-T 치료제 개발사들은 자사의 치료제와 악성종양 부작용 사이에 인과관계가 입증되지 않았다고 강조한다. 무엇보다도 FDA가 이들 6종 제품의 시판을 계속 허용했다는 게 중요하다. 정말로 혈액암 부작용이 크게 문제가 된다면 경고 문구 추가에서 끝나지 않고 FDA가 허가를 취소했을 것이기 때문이다.
이 시각 인기 뉴스
식품의약품안전처(식약처)도 안전성 이슈를 인지해 일찌감치 국내 모니터링에 착수했다. 킴리아와 카빅티를 처방한 후 T세포 악성종양 의심 부작용이 발생하면 보고해달라는 서한을 지난달 배포했다. 식약처 관계자는 "아직 국내에선 T세포 악성종양 부작용이 보고된 사례는 없다"며 "해당 부작용은 앞선 임상시험에서도 발견돼 인지하고 있었던 부분"이라고 설명했다.
이어 "해외에서 의약품 허가사항 문구가 변경되면 식약처에 보고되는 시스템이 갖춰져 있다"며 "이번 안전성 이슈와 관련한 조치 계획을 제약사 측에 요청했고, 국내 허가 문구 보강 등 계획을 준비하는 것으로 안다"고 밝혔다.
정준호 서울대학교 의과대학 암 연구소 교수는 "1000명의 1~2명 환자에서 CAR-T 치료로 혈액암이 발생한다고 해서 처방을 중단할 것인가 생각해보면 대부분 임상 의사는 거기에 반대할 것"이라며 "실제로 말기 혈액암 환자가 치료받지 않았을 때 리스크(위험)보다 CAR-T 처방의 이득이 더 크다는 게 의료계의 합의된 시각"이라고 설명했다.
그러면서 "이번 안전성 문제가 기존의 (신약 개발) 임상시험 프로토콜에 줄 수 있는 영향은 굉장히 제한적이거나 거의 없다"고 말했다.
