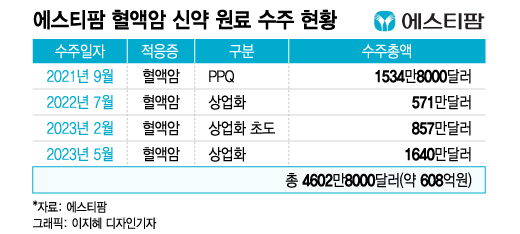
31일 업계에 따르면, 에스티팜은 전날 미국 소재 바이오기업으로부터 1640만달러(약 218억원) 규모의 올리고핵산 치료제 상업화용 모노머(중간체·Amidite) 공급 계약을 체결했다고 밝혔다.
에스티팜은 이번 RNA 치료제가 혈액암 적응증의 신약이라고 밝혔다. 올해 6월 미국 식품의약국(FDA)에 품목허가 신청이 들어가고 내년 1분기 상업화 승인을 받을 것으로 예상된다고 덧붙였다.
첫 수주는 지난 2021년 9월이다. 혈액암 치료제의 상업화 시험 생산(PPQ) 배치용 원료 의약품 공급 계약을 체결했다. 계약 금액은 1534만8000달러다. PPQ는 세 번의 시험 생산으로 의약품이 균등한 품질로 만들어지는지 확인하는 절차다. 신약 허가 신청에서 필요한 과정이다.
이어 2022년 7월과 올해 2월에 각각 571만달러, 857만달러의 상업화 물량 공급 계약을 체결했다. 이번 1640만달러 공급 계약까지 더하면 누적 수주 금액은 4602만8000달러(약 608억원)다.
이 시각 인기 뉴스
이메텔스타트는 골수형성이상증후군(MDS)을 치료하는 RNA 치료제다. MDS는 골수 이상으로 적혈구 등 혈액 세포를 생산하지 못하는 병이다. 병에 걸리면 지속적으로 수혈받아야 한다. 올해 초 발표된 이메텔스타트 임상 3상 시험 결과에 따르면, 투약 후 8주 차에 수혈이 필요 없는 환자 비율은 치료군에서 39.8%(47명)를 기록했다. 위약군에서는 15%(9명)에 불과했다. 환자 10명 중 4명은 약 1년 동안 수혈을 받지 않아도 됐다.
제론은 이메텔스타트의 신약 허가 신청(NDA)을 올해 6월 FDA에 제출하겠다고 밝혔다. 그러면서 내년 상반기에 정식 출시하겠다고 했다. 앞서 에스티팜이 설명한 혈액암 치료제의 허가·상업화 일정과 일치한다.
RNA 항암제 치료제에는 일반 약보다 더 많은 양의 원료가 들어간다. 현재 시판되는 이상지질혈증 치료제에는 환자 1인당 1년에 600㎎의 올리고핵산이 투입된다. 이메텔스타트에는 이것의 10배인 6000㎎이 투여되는 것으로 알려졌다.
앞서 제론은 이메텔스타트가 오는 2030년 최대 12억달러(약 1조5000억원) 매출을 올릴 것으로 예상한다고 밝혔다.
에스티팜은 "우리는 2000년대 초까지 전 세계에서 모노머를 가장 많이 만들던 회사였다"며 "올리고뉴클레오타이드의 전 단계 물질인 모노머 Amidite를 제조·품질 관리 기준(GMP)으로 대량 생산할 수 있는 유일한 기업이다"고 강조했다.
이어 "상업화된 고지혈증·혈액암 치료제에 올리고 및 그 중간체인 모노머를 동시에 공급하고, 현재 임상 3상이 진행 중인 만성B형 간염 치료제까지 모노머 공급 논의가 확대 중"이라며 "자사의 올리고 위탁 생산·개발(CDMO) 매출은 더욱 확대될 전망이다"고 밝혔다.
