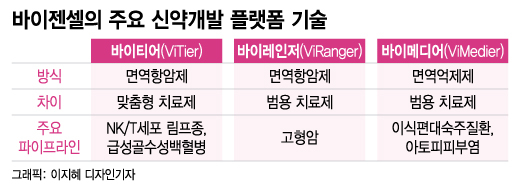
바이젠셀은 면역 항암 치료제 플랫폼 바이티어(ViTier)로 개발하는 NK/T세포 림프종 치료제(VT-EBV-N)의 임상 2상 환자 모집이 사실상 마무리 단계에 들어섰다고 8일 밝혔다. 바이티어는 바이젠셀의 항원 특이 살해 T세포(CTL) 치료제 개발 플랫폼이다.
VT-EBV-N은 앞서 NK/T세포 림프종 환자 11명을 대상으로 실시한 연구자 주도 임상에서 장기 추적 관찰 결과 무재발생존율 90%, 전체생존율(5년) 100%를 나타냈다. 전임상뿐 아니라 사람 대상 임상시험에서 안전성과 유효성을 확인한 파이프라인이라 현재 진행 중인 허가용 임상 2상에 대한 기대가 크다.
바이티어 플랫폼으로 개발하는 급성골수성백혈병(AML) 치료제(VT-Tri(1)-A) 역시 환자 9명을 대상으로 허가용 임상 1상이 진행 중이다. 앞서 10명의 환자를 대상으로 실시한 연구자 주도 임상에서 무재발생존율 71.4%, 2년 재발율 0%를 확인했다. 임상 1상에 진입한 뒤 1년 이상이 경과하면서 이르면 올해 중간 데이터를 확보할 수 있을 것으로 관측된다.
감마델타T세포 기반 신약 개발 플랫폼 바이레인저(ViRanger)에 대한 연구도 진척되고 있다. 현재 범용 고형암 치료제(VR-CAR) 후보물질에 대한 전임상 효력 시험을 진행하고 있다. 전임상 결과를 토대로 향후 임상 1상에 진입한 뒤 적극적으로 기술이전 파트너를 물색할 계획이다.
이 시각 인기 뉴스
바이젠셀의 면역억제 치료제 플랫폼 바이메디어(ViMedier)로 개발하고 있는 이식편대숙주질환(VM-GD) 치료제와 아토피피부염 치료제(VM-AD)도 지켜볼 필요가 있다. VM-GD는 희귀의약품 지정을 통한 조기 상업화와 적응증 확장을 목표로 연구를 진행하고 있다. VM-AD는 전임상에서 효력을 확인한 데 이어 호주에서 임상 시험을 준비하고 있다.
바이젠셀 관계자는 "NK/T세포 림프종 치료제는 허가용 임상 2상 환자 등록 완료를 목적에 두고 있다"며 "임상 2상에 성공한 뒤 빠른 상업화를 위해 조건부 품목허가를 추진할 것"이라고 말했다. 또 "전임상에서 우수한 효능을 확인한 바이레인저 기반의 CAR-감마델타T세포 치료제 후보물질을 고도화해 사업화 성과를 창출하는 데 집중하겠다"고 말했다.
