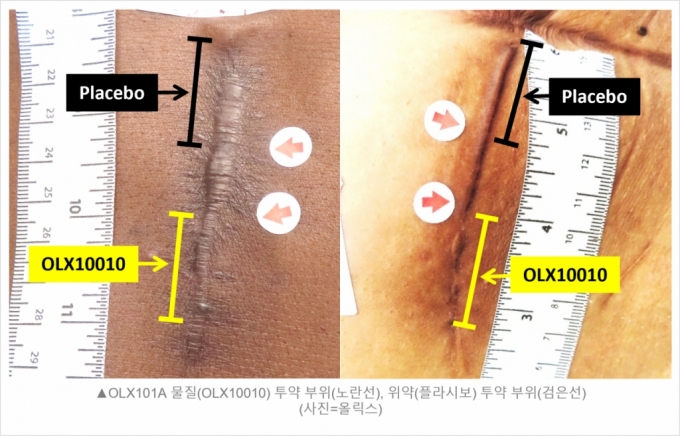
OLX101A의 1차 평가지표는 흉터 재건술로부터 24주 시점에 연구자의 POSAS(Patient and Observer Scar Assessment Scale) 스코어를 이용해 비대흉터의 재발 정도를 비교하는 것이었다. 1차 평가지표는 1부터 10까지의 숫자로 측정된 '베이스라인(Baseline, 투약 전) 흉터의 시각적 및 촉각적 특성의 전반적인 심각도'를 투약 24주 후 재측정해 흉터의 개선 정도를 수치로 측정하도록 설계됐다. 심각도 점수가 낮을수록 정상 피부에 가깝다는 의미다.
올릭스는 현재까지 진행된 저용량과 고용량 투여군 모두에서 약물의 안전성과 내약성을 확인했다. 흉터 제거 수술을 받은 피부에 수차례 약물을 투여했음에도 안전성에 관련된 어떠한 문제도 발견되지 않았다.
임상 시험에 참여한 마이애미 밀러 의대의 웨이블 박사는 "현재까지 적절한 비대흉터 치료제가 없어 환자 수가 많음에도 비대흉터는 여전히 치료가 어려운 상황이다. 비대흉터의 섬유화 과정에서 CTGF(Connective tissue growth factor)는 주요한 인자인데, OLX101A는 이 CTGF의 발현을 저해하는 새로운 작용 기전과 적은 투여 횟수로도 치료 효과를 보이는 치료제"라며 "특히 이번 임상에서 확인된 OLX101A의 안전성 데이터로 볼 때, OLX101A는 비대흉터 환자에게 가장 먼저 사용할 수 있는 1차 치료제가 될 것"이라고 말했다.
이동기 올릭스 대표이사는 "비대흉터 치료제의 2상 임상시험 톱라인 결과에서 통계적으로 유의미한 임상 효력이 확인된 것은 올릭스에서 개발 중인 치료제 중 최초로 휴먼 PoC(개념 증명, Proof of Concept)를 확보한 것으로 대단히 고무적인 성과"라며 "이번 임상 결과를 바탕으로 비대흉터 치료제에 관심을 보이는 글로벌 유수 제약 기업 등과 파트너링을 추진할 것"이라고 말했다.
