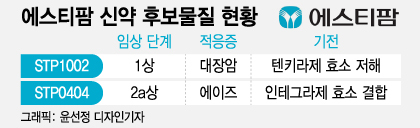
20일 제약업계에 따르면 에스티팜은 STP1002의 임상 1상 중 일부 동일집단의 임상을 마무리한 것으로 파악됐다. 코호트7(동일집단 7) 임상 1상이 종료돼 내부 안전성 모니터링위원회에서 안전성을 확인한 것으로 전해졌다.
STP1002는 텐키라제(Tankyrase) 효소를 저해해 암세포 성장을 막는 기전으로 세계 최초의 경구용 대장암 치료제로 개발중이다. 기존 대장암치료제인 머크의 얼비툭스에 치료효과를 보이지 않는 환자를 치료할 수 있는 신약으로 기대된다. 계열 내 최초 신약인 만큼 STP1002가 파고들 시장 규모도 상당하다. 회사측은 STP1002가 최종 개발될 경우 겨냥할 시장 규모를 19억달러(약 2조5000억원) 규모로 추정한다.
임상 1상 일부 코호트 종료에 따라 안전성을 확인하고, 전임상에서 병용 투여 가능성도 증명한 STP1002의 전체 임상 1상 세부 내용도 조만간 공개될 예정이다. 회사 관계자는 "올해 상반기 중 임상1상 세부 결과를 발표할 예정"이라고 말했다. 회사가 미국 국립보건연구원(NIH)의 임상정보 제공 사이트 클리니컬트라이얼스에 등록한 STP1002의 개발 계획에 따르면 해당 임상 1상은 오는 5월 중간결과를 도출해 9월 최종 종료될 예정이다.
이 같은 일정을 감안하면 STP1002는 이르면 연내 글로벌 임상 2상 신청 단계에 들어설 것으로 보인다. 3단계를 거치는 신약 임상 과정에서 2상부터는 신약의 효능을 증명하는 개발 '본게임' 격이다. 신약 후보물질의 가치가 본격적으로 불어나 기술수출도 활발히 진행되는 시점이기도 하다. 에스티팜은 현재 STP1002외에 에이즈 치료신약 'STP0404'도 미국 임상 2상에 진입한 상태다. 기존 에이즈 치료제의 내성을 극복할 수 있는 치료제로 세계 최초 에이즈 완치 치료제로서의 가능성을 임상 2상에서 증명한다는 계획이다.
이 시각 인기 뉴스
회사 관계자는 " 다음달 STP0404 임상 2상의 첫 환자 투약을 시작할 예정"이라고 말했다. STP0404는 경구 투여용으로 개발 중이며 장기 지속형 주사제 개발도 병행되고 있다. 기존 에이즈치료제와의 병용 투여 임상 가능성 평가도 진행중인 것으로 전해졌다.
