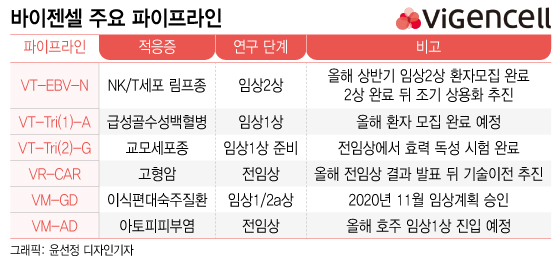
바이젠셀은 VT-EBV-N의 임상 2상을 위한 환자 모집을 올해 상반기 완료할 계획이라고 9일 밝혔다. VT-EBV-N은 개발 단계에서 희귀의약품 지정을 승인받아 임상 2상 종료 뒤 조기 상업화를 노릴 수 있다.
또 NK/T 림프종 환자 11명을 대상으로 한 연구자 주도 임상에서 장기 추적 관찰 결과 무재발생존율 90%, 전체생존율(5년) 100%를 기록했다.
VT-EBV-N이 상업화에 성공할 경우 다른 고형암 등으로 적응증 확장이 가능하다. 또 같은 환자 맞춤형 면역항암 세포치료제 플랫폼(바이티어)으로 만든 파이프라인인 VT-Tri(1)-A, VT-Tri(2)-G의 연구에도 속도가 붙을 수 있다.
바이젠셀은 VT-Tri(1)-A를 난치성 급성골수성백혈병(AML) 치료제로 개발하고 있다. 2020년 9월 허가용(1상) 임상 시험계획(IND)을 승인받은 뒤 현재 임상 1상을 진행하고 있다. VT-Tri(2)-G의 경우 악성교모세포종(glioblastoma) 치료를 위한 허가용 임상(1상)을 준비하고 있다.
이 시각 인기 뉴스
앞서 바이젠셀은 성공적인 면역세포 치료제 연구를 위해 자체적으로 GMP(우수 의약품 제조 및 품질 관리 기준) 세포 생산시설을 확보했다. 이를 통해 스스로 임상을 위한 세포 생산을 할 수 있을 뿐 아니라 품목허가 때 빠른 상업 생산이 가능하다.
또 면역억제(바이메디어) 기반 플랫폼 파이프라인 중 아토피피부염 치료제(VM-AD)는 곧 호주에서 글로벌 임상시험을 위한 시험계획을 제출하고 연내 임상 시험에 진입할 계획이다. 이식편대숙주질환 치료제(VM-GM)는 임상 1/2a상 단계다.
바이젠셀의 또 한 축인 감마델타T세포 기반 범용 치료제 플랫폼(바이레인저)은 기술수출을 추진한다. 현재 간암을 비롯한 고형암 치료제로 전임상을 진행하고 있다. 연내 전임상 결과를 발표한 뒤 기술이전을 위한 논의에 본격적으로 나설 계획이다.
바이젠셀 관계자는 "올해 바이티어 파이프라인인 VT-EBV-N의 임상 2상을 순조롭게 완료하고 향후 보다 빠른 상업화를 위해 조건부 품목허가를 신청할 계획"이라며 "또 다른 플랫폼인 바이메디어의 경우 올해 호주에서 글로벌 임상에 진입하고, 바이레인저의 경우 전임상 결과 발표를 통한 기술수출을 추진하겠다"고 말했다.
