하지만 에이비엘바이오 (28,900원 ▲750 +2.66%)는 "부분 임상 보류는 IND(임상시험계획) 승인 거절을 뜻하지 않는다"며 "FDA 가이드라인에서 부분 임상 보류는 'IND에 따라 요청된 임상 관련 업무의 일부만 연기 또는 중단'을 뜻한다"고 설명했다.
에이비엘바이오 관계자는 "IND 신청 후 고용량에 대한 우려 코멘트를 받아 이를 해결하고자 고용량을 빼고 IND를 변경 신청했다"며 "이를 통해 자사는 문제가 해결됐다고 생각했다"고 전했다.
하지만 이번 오피셜 레터는 변경 신청이 아닌 최초 신청건에 대한 답변이었다는 게 회사 측 설명이다. 즉 에이비엘바이오가 이번 IND 심사에선 판단을 받지 않기로 했던 고용량 임상에 대한 판단을 받은 것이란 의미다. 이미 에이비엘바이오는 변경 신청 당시 고용량 임상은 임상 진행 중 프로토콜을 변경해 다시 시도하겠단 계획을 세웠다.
이 시각 인기 뉴스
따라서 현재로선 변경 신청 당시와 회사가 그린 ABL301 1상 절차가 "달라진 건 없다"는 게 회사 측 설명이다. 이에 에이비엘바이오는 예정대로 곧 ABL301 저용량 임상을 개시할 방침이다. 이를 위해 최근 중국 당국으로부터 우시바이오로직스에서 생산한 약을 미국으로 수출할 수 있도록 허가를 받았다. 선적은 근시일 내 가능할 것이란 관측이다.
동시에 에이비엘바이오는 저용량 임상을 진행하는 한편 FDA 요청에 따라 ABL301 고용량에 대한 비임상 독성시험(GLP tox study)를 추가 진행할 계획이다. 이를 기반으로 추가 데이터를 제출하겠단 방침이다.
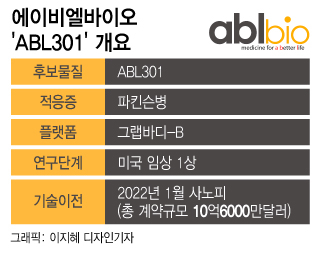
에이비엘바이오 관계자는 "부분 임상 보류를 기반으로 저용량 임상을 시작하기 위한 임상 준비 과정이 진행 중"이라며 "기술이전 및 공동개발 파트너사인 사노피와도 ABL301 임상이 차질 없이 진행될 수 있도록 긴밀한 논의와 협력을 지속하고 있다"고 말했다. 에이비엘바이오는 올해 초 사노피에 ABL301을 총 1조3000억원 규모로 기술이전했다.
증권가에서도 이번 심사결과를 놓고 임상 실패로 연관짓긴 과도하다는 판단을 내놨다. 허혜민 키움증권 연구원은 "ABL301 물질의 독성 이슈가 있어서가 아니라 뇌혈관장벽(BBB) 셔틀 플랫폼 기반의 첫 임상 진입이고 IGF1R 타겟으로도 처음이기 때문에 안전하게 진행되길 규제당국은 원하는 것으로 추측된다"며 "임상 실패 혹은 플랫폼 리스크로 연관 짓기에는 과도하다는 판단"이라고 했다.
엄민용 현대차증권 연구원은 "사노피는 지난 9월 15일 동사의 비임상 독성시험에 대해 단계별 마일스톤 2000만달러(278억원)를 지급한 바 있다"며 "비임상 독성시험이 사노피와 충분히 논의된 결과임을 알 수 있다"고 말했다. 이어 " 레카네맙과 같은 부작용 발생을 우려한 FDA가 보수적 접근을 고수한 것으로 추정한다"고 덧붙였다.
