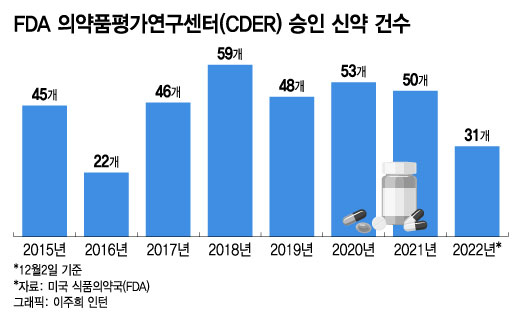
5일 업계에 따르면 FDA의 의약품평가연구센터(CDER)는 올해 1월1일부터 이달 2일까지 총 31개 신약의 시판을 승인했다. CDER은 FDA 안에서 의약품 심사와 승인을 담당하는 조직이다. 저분자 화합물과 생물학적 제재 등 대부분의 신약 허가를 담당한다. 31개 의약품에는 백신과 세포·유전자 치료제, 혈장 제제 등은 포함되지 않는다.
이같은 승인 현황은 2016년 이후 6년 만에 가장 낮은 수치다. 2016년 22개 신약이 FDA로부터 허가받았다. 이후 △2017년 46개 △2018년 59개 △2019년 48개 △2020년 53개 신약이 승인됐다. 지난해에도 12월27일 아토피 피부염 치료제 '애드브리(Adbry)'를 마지막으로 50개 신약이 FDA 심사 관문을 뚫어냈다.
칼리프 국장은 지난해 11월 조 바이든 미국 대통령으로부터 FDA 신임 국장으로 지명됐다. 칼리프 국장은 2016년 2월부터 2017년 1월까지 버락 오바마 대통령 시절에도 FDA를 이끈 적이 있다.
당시 FDA가 마약성 진통제 오피오이드를 다섯 종이나 승인하면서 수장이었던 칼리프 국장도 책임을 피하기 어렵게 됐다. 최근 과다 복용 사망자가 급증해 악명을 떨친 '펜타닐'도 오피오이드 성분이다.
이 시각 인기 뉴스
또한 2016년 사렙타(Sarepta therapeutics)의 뒤셴 근이영양증 치료제 엑손디스51 허가에도 칼리프 국장은 논란의 중심에 있었다. 임상 효능 부족으로 치료제 허가를 두고 FDA 내부에서 의견 대립이 있었으나 당시 CDER 책임자였던 재닛 우드콕이(Janet Woodcock) 승인을 강행했다. 이에 FDA 내부에서 당시 국장이었던 칼리프에게 번복을 요청했으나, 그는 응하지 않았다.
지난해 6월 FDA가 알츠하이머 치매 신약 아두헬름을 승인해 비판받은 것도 영향을 미친 것으로 보인다. 아두헬름은 임상 3상에서 유효성 논란이 있었지만 FDA는 알츠하이머 치매의 미충족 의료수요가 크다는 이유로 시판을 허가했다. 당시 FDA 자문위원회 11명 중 10명이 반대했을 만큼 아두헬름 승인에는 반대 여론이 압도적이었다.
그러나 허가 이후에도 아두헬름은 의료 현장에서 거의 사용되지 못했다. 개발사 바이오젠이 약가를 50%까지 낮추는 등 노력했지만 끝내 아두헬름은 미국 보험 적용에서 제외됐다. 유럽과 일본은 아예 시판을 허가하지 않았다. FDA가 아두헬름 허가로 손상된 신뢰를 회복하기 위해 올해 신약 심사 기준을 강화한 것 아니냐는 분석이 나오는 이유다.
다만, FDA의 엄격해진 심사가 국내 제약·바이오 기업에 미치는 영향은 제한적일 것으로 예상된다. 국내에서는 셀트리온의 램시마SC와 삼성바이오에피스와 동아에스티의 스텔라라 바이오시밀러가 FDA 심사에 도전할 계획이다. 유한양행의 폐암 신약 '레이저티닙'도 내년에 FDA 허가 신청이 예정돼 있다.
허혜민 키움증권 연구원은 "대부분 바이오시밀러의 FDA 승인에는 무리가 없을 것으로 판단한다"며 "레이저티닙은 임상 3상 단독 요법 탑라인의 성공적인 발표로 (FDA 허가) 가능성은 높을 것으로 전망한다"고 설명했다.
