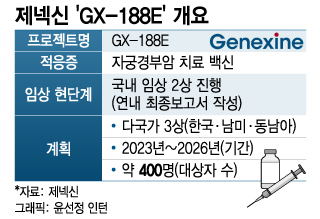
24일 바이오 업계에 따르면 제넥신은 국내에서만 실시하려고 했던 GX-188E의 임상 3상을 최근 한국, 남미, 동남아시아로 확장하기로 했다. GX-188E는 자궁경부암 치료 백신이자 HPV16·18 유래암 치료 DNA 백신으로, 제넥신의 주력 후보물질로 꼽힌다. 현재 국내에서 진행성·재발성 자궁경부암 환자를 대상으로 임상 2상을 진행 중이다. 최근 65명 환자에 투약을 완료해 연내 최종보고서를 작성하는 게 목표다.
GX-188E 3상은 진행성·재발성 자궁경부암 환자 약 400명을 대상으로 실시될 예정이다. 대조군 대비 GX-188E와 펨브롤리주맙 등 면역관문억제제 병용투여 유효성을 확증하는 게 목적이다. 현재 제넥신은 내년 1분기 중 GX-188E 3상을 개시해 오는 2026년 종료하는 것을 목표하고 있다. 이를 위해 최근 추진 중인 1000억원 규모 유상증자 성공시, 이중 347억원을 GX-188E 임상에 투입하기로 했다.
실제 제넥신은 GX-188E 외에도 최근 불응성·재발성 삼중음성 유방암에 대한 GX-17 임상을 다국가 2상으로 진행하기로 결정했다. 이 역시 한국에서만 진행하려고 했던 임상이다. 일단 제넥신은 GX-17도 한국, 중국, 동남아시아에서 약 114명의 환자를 대상으로 실시하겠다는 계획을 밝혔다. 이 역시 내년 1분기 개시해 2026년 완료하는 게 목표다.
물론 제넥신이 후보물질 가능성을 높게 보고 속도를 내는 측면도 있다. 지난달 제넥신이 유럽종양학회(ESMO)에서 발표한 결과에 따르면 환자 60여명을 대상으로 GX-188E와 키트루다를 병용투여한 2상의 객관적 반응률(ORR)은 31.7%, 총 생존기간 중앙값은 17.2개월였다. 제넥신 측은 "PD-L1 음성 종양환자의 ORR이 키트루다 단독요법에선 0%, GX-188E와 키트루다 병용요법에선 25%였다"고 했다.
이 시각 인기 뉴스
자궁경부암 치료도 고성장세가 점쳐지는 시장이다. 글로벌 의약품 조사기관 글로벌데이터에 따르면 미국, 중국 등 8개 주요국가의 자궁경부암 치료제 시장 규모는 2020년 6억달러(8643억원)에서 2030년 48억달러(6조9144억원)로 연평균 23% 성장할 전망이다. 제넥신 관계자는 "남미, 동남아도 (자궁경부암) 환자 수가 많아 시장성이 높다"며 "임상 진행으로 추후 허가에서도 유리할 것으로 본다"고 했다.
