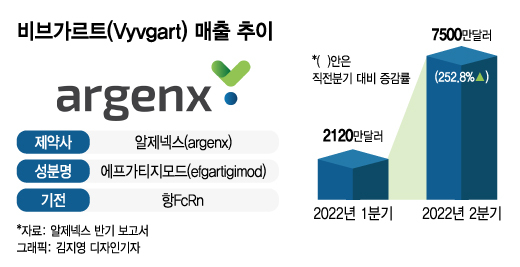
16일 업계에 따르면 네덜란드 바이오 기업 알제넥스(argenx)는 올해 상반기 비브가르트로 9600만달러(약 1253억원)의 매출을 올렸다.
올해 상반기 비브가르트 매출이 주목받는 이유는 애널리스트들의 전망치를 크게 뛰어넘었기 때문이다. 출시 초기, 업계의 비브가르트 2022년 매출 컨센선스(시장 전망치)는 약 1억달러(약 1306억원)였다. 그러나 두 분기 만에 1년 전망치에 근접한 매출을 올리며 기대 이상으로 선전했다.
한올바이오파마는 비브가르트의 경쟁 제품이 될 HL161을 개발 중이다. 미국에서는 이뮤노반트가, 중국에서는 하버바이오메드가 각각 임상을 진행하고 있다.
비록 경쟁 제품이지만 비브가르트 선전으로 HL161의 시장 진입도 쉬워졌다는 평가가 나온다. 이전에 없던 새로운 계열의 약을 출시하면 시장 진입이 어렵다는 단점이 있다. 의사들이 잘 알려지지 않은 신약을 사용하기 꺼리기 때문이다. 그러나 비브가르트는 출시 이후 의료계와 환자에게 약효를 입증하며 빠르게 시장을 개척했다. 시장조사기관 스페릭스 글로벌 인사이트에 따르면 미국 신경학자 과반(51%)이 "비브가르트가 기존 약보다 훨씬 진보된 치료를 제공한다"고 답했다.
이 시각 인기 뉴스
한올바이오파마 관계자는 "중증근무력증 환자 커뮤니티에서도 효과가 좋다며 입소문이 나는 것 같다"며 "같은 계열의 약이 잘 팔리고 자리를 잡아야 우리의 약도 나중에 출시됐을 때 잘 될 수 있기 때문에 상당히 기대된다"고 말했다.
HL161은 피하주사(SC) 제형으로 개발되고 있다. 비브가르트는 앞서 정맥주사(IV) 제형으로 승인받았는데 알제넥스는 올해 연말까지 FDA에 SC 제형 제품의 허가를 신청할 계획이다.
SC 제형은 전체 항FcRn 치료제 시장에서 점유율 약 70%를 차지할 것으로 예상되는 만큼 개발이 필수적이다. HL161이 개발에서 조금 뒤처졌지만 비브가르트 대비 더 빠른 투약 시간으로 경쟁력을 갖출 예정이다.
HL161 SC 제형의 1회 투여 용량은 340㎎과 고용량 680㎎으로 나뉘며 투약 시간은 10초 이내로 예상된다. 반면 비브가르트 SC의 1회 투여 용량은 1000㎎으로 투약에 최소 수 분이 걸릴 것으로 보인다.
또 HL161은 환자 직접 투여가 가능하도록 개발되고 있어 편의성에서 더 좋다는 게 한올바이오파마의 설명이다. 환자가 일주일에 한 번씩 병원에 가는 수고가 줄어드는 것이다. 반면 비브가르트 SC 제형은 환자의 자가 투여가 불가능할 것으로 예상된다.
