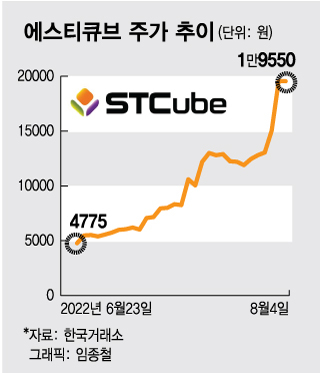
4일 한국거래소에 따르면 이날 에스티큐브의 주가는 1만9550원으로 장을 마감했다. 6주 전인 지난 6월23일 4775원 대비 4배 이상 급등했다.
회사는 지난해 4월 미국암학회(AACR)를 통해 BTN1A1을 공개한 뒤, 12월 영장류 독성시험 결과를 바탕으로 미국 식품의약국(FDA)과 국내 식품의약품안전처에 임상시험계획서(IND)를 제출했다. 올해 1월과 3월 FDA, 식약처의 임상 승인을 획득한 뒤, 4월 국내병원 환자 투여를 시작으로 글로벌 임상이 본격화 된 상황이다. 완료 예상 시기는 내년 상반기다. 임상에 필요한 항체 생산은 삼성바이오로직스가 맡았다. 임상 본격화 이후 지난 6월 바이오USA에서는 다수 글로벌 대형 제약사들과 기술이전 등을 위한 1:1 미팅을 진행했다. 특히 비밀유지계약(CDA)와 후속 미팅 확정 소식 등이 전해지며 기술이전에 대한 기대감이 커졌다.
이처럼 전세계 시장에서 가장 많이 사용되는 면역항암제들이지만 환자에서의 반응률은 절반을 넘지 못하고 있다. 국내외 다수 기업들이 앞다퉈 면역항암제와의 병용 용법 파트너 지위를 노리는 이유 역시 반응률 높이기 위함이다. hSTC810은 새로운 바이오마커 BTN1A1을 표적하는 기전을 통해 기존 면역항암제들에 반응하지 않은 환자들의 치료 효과를 기대할 수 있다는 점에서 주목받는 중이다.
특히 에스티큐브는 자체 연구를 통해 확인한 hSTC810의 BTN1A1과 PD-L1 대상 배타적 발현에 주목하고 있다. BTN1A1 단독 용법은 물론, PD-L1과의 병용 투여까지 가능하다는 입장이다. 두 항체를 함께 항암 치료에 활용해 매년 20% 이상의 시장 성장률을 보이는 면역항암제 시장 내 중심축으로 자리잡겠다는 포부다.
이 시각 인기 뉴스
에스티큐브 관계자는 "현재 임상은 단독으로 디자인 됐지만 배타적 발현과 동시 발현의 경우를 모두 확인한 만큼 병용 시 효과도 높을 것으로 보고 있어 향후 병용 계획도 있다"며 "전임상 단계에서의 효능을 충분히 확인한 상태로, 오랜만의 새 면역관문억제제 후보물질 등장에 대한 내부 기대감도 적지 않은 상황"이라고 설명했다.
회사는 오는 11월 면역항암학회(SITC)에서 임상 1상 중간 결과 발표를 목표로 하고 있다. 적정용량과 안정성을 평가하기 위한 5개 용량 중 3개 용량에 대한 검증이 가능할 것이란 입장이다. 추가 임상 격인 Backfill 효능검사도 함께 진행 중이다. 면역항암제 특성상 1상에서 안정성과 유효성을 확인하면, 확대 임상을 통해 조건부허가 획득이 가능하다. 키트루다 역시 폐암을 대상으로 한 임상 3상이 최근에 끝났지만, 허가 시점은 1상 마무리 시점인 지난 2015년이다. 에스티큐브가 1상 단계 기술이전이 용이하도록 의도적으로 설계한 임상 디자인이다.
김학준 키움증권 연구원은 보고서를 통해 "기존 면역항암제들에 반응하지 않는 환자에 대한 효능이 나타날 것으로 본다는 점과 동물(생쥐) 실험단계에서 종양성장 억제를 확인했다는 점에서 결과에 대한 효능성 동의만 받으면 기술수출과 신규 면역관문 단백질로의 선정 가능성이 높아질 것으로 전망된다"며 "6월 ASCO 발표에서 해외업체들과 전임상 데이터들을 공유했다는 점에서, 오는 11월 SITC에서 중간 결과를 발표하는 시점이 가장 중요한 변곡점이 될 것으로 보인다"고 분석했다.
