"파킨슨병 신약 美 2상에 '디지털 헬스' 적용…정확도 높인다"
머니투데이 박미리 기자
2022.06.24 08:22
이재문 카이노스메드 사장 인터뷰
작년말 KM-819 美 2상 IND 승인, 개시는 내달말
카이노스메드 (4,275원 ▲85 +2.03%)가 파킨슨병 치료제 임상 2상에 디지털 헬스케어를 활용하기 위한 계약을 추진 중이다. 손 떨림 등 파킨슨병 환자의 증상 변화를 보다 오랜기간 정확하게 추적할 수 있어 임상 성공률을 높이는 데도 도움이 될 것이라고 회사 측은 기대하고 있다.
이재문
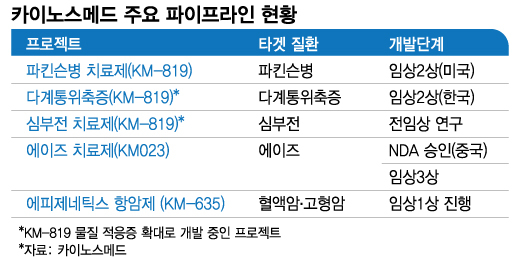
카이노스메드 (4,275원 ▲85 +2.03%) 사장은 지난 13~16일(현지시간) 미국 샌디에이고에서 열린 '2022 바이오USA'에서 머니투데이와 만나 파킨슨병 치료제로 개발 중인 KM-819 미국 임상 2상과 관련해 이같이 말했다. KM-819는 'LRRK2'나 'aSyunclein'을 타깃하는 경쟁사들과 달리 자체 개발한 FAF1을 타깃하는 신약이다. FAF1은 세포의 죽음을 촉진하는 단백질이다. 카이노스메드에 따르면 KM-819는 FAF1가 지나치게 많이 나오는 것을 억제해 신경세포 사멸을 막고 불필요한 세포 성분을 제거하는 기능을 활성화해 파킨슨병 주요 원인인 알파시누클레인 축적을 막는다.
미국 FDA(식품의약국)에서 시험계획 승인을 받은지 6개월이 지났지만 아직 KM-819 미국 2상은 개시되지 않은 상태다. 이 사장은 "4월 환자 투여가 목표였으나 변경할 부분이 하나 생겼고 현지 인력난까지 더해지면서 일정이 지연됐다"며 "다음달 말엔 환자 투여가 실시될 것"이라고 했다. 미국 2상 완료 목표시점은 2025년 초(리포트 발표 이후 약 6개월)로 계획에 변동이 없다.
이 임상 2상에 디지털 헬스케어가 활용되는 것이다. 이 사장은 "진단하는 웨어러블 앱을 개발한 글로벌 빅파마와 사용을 위한 계약을 추진 중"이라며 "FDA에서 해당 빅파마에 다른 기업들도 (웨어러블 앱을) 쓸 수 있도록 해달라고 제안했고, 이후 카이노스메드 측에서 해당 회사에 접촉해 임상 사용에 동의한다는 합의를 이끌어냈다"고 설명했다. 해당 앱은 파킨슨병 환자 전용이다. 11개 센서로 구성돼 파킨슨병 환자의 증상 변화를 다각도로 파악할 수 있다. 이 사장은 "환자들의 증상 악화가 이전엔 패턴 정도로만 보였다면 이제는 상세하게 볼 수 있는 것"이라고 했다.
따라서 해당 앱을 사용하면 임상 진행에도 긍정적이라는 게 이 사장 설명이다. 그는 "그 동안 파킨슨병 환자 데이터는 석 달에 한번씩 의사와 만나 한 시간가량 질문하고 대답하는 방식으로 축적이 됐다. 정확도가 떨어질 수밖에 없는 방식"이라며 "해당 앱은 하루 종일 함께 하면서 모든 기록을 정확히 축적할 수 있다는 이점이 있다. 데이터 전송도 일주일에 한 번씩 이뤄진다"고 했다. 예컨대 파킨슨병 환자 주요 증상으론 손 떨림이 있다. 손이 떨릴 때마다 얼마나 세게, 자주, 오랫동안 떨림이 이뤄지는지 기록돼 병원에 전송되는 식이다. 발폭, 말 속도 등 변화도 파악할 수 있다.
이 사장은 "파킨슨, 알츠하이머 임상에서의 문제가 날씨, 감정 등 여러 요인이 작용해 데이터가 오르락내리락할 수 있다는 것"이라며 "해당 앱을 사용하면 이런 가능성을 원천 차단해 데이터 분석이 확실해지고 결과가 뚜렷해진다. 임상 콘트롤이 더욱 잘 되게 된다"고 설명했다. 해당 앱은 내년 임상부터 적용될 예정이다. 현재 카이노스메드는 KM-819 미국 임상 2상을 1~3단계(노인 대상 용량 증량, 파킨슨 환자 대상 1상보다 용량 증량, 파킨슨 환자 상대 최대 허용 용량으로 2년)로 진행할 계획이다. 이중 마지막인 3단계에 해당 앱을 적용하겠다는 얘기다.
이번 바이오USA에서도 성과가 있었던 것으로 평가했다. 이 사장은 글로벌 빅파마들과 만나 KM-819 등 파이프라인을 소개했다. 그는 "글로벌 2상에 들어간다는 데 의미를 두는 느낌이 컸다"며 "일부는 파트너링을 원한다면서 서두르는 등 적극적인 자세가 보였다"고 전했다. 다만 "이번 미팅에서 '지금은 공동개발을 위한 파트너링 관계, 기술이전은 2상 끝날쯤 원한다'고 못을 박았다. 지금 기술이전을 하면 가치를 많이 못받을 수 있기 때문"이라며 "빅파마여도 우리보다 우리 물질에 대해 잘 알 순 없다. 2상까진 우리가 주도적으로 진행해 가치를 키우고 싶다"고 했다.
<저작권자 © ‘돈이 보이는 리얼타임 뉴스’ 머니투데이. 무단전재 및 재배포, AI학습 이용 금지>