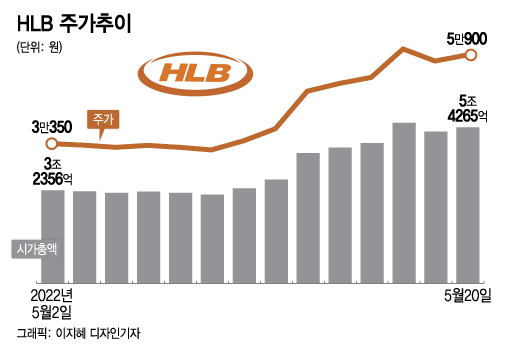
HLB의 단기간 급등은 최근 다소 침체된 제약·바이오 업종과 상반된 모습이다. 같은 기간 각종 대외 변수 속 악화된 제약·바이오 업종 투심에 KRX헬스케어지수는 2885.92에서 2916.62로 제자리걸음 수준에 그쳤기 때문이다.
연간 1조원 이상의 매출을 기록 중인 넥사바 대비 우월한 리보세라닙 효능 확인은 고스란히 회사 주가에 반영됐다. 기존 치료제 대비 높은 가격 경쟁력으로 시판허가를 받아 시장 점유율을 빠르게 늘리겠다는 회사의 전략도 기대감을 키우는 요소로 작용했다.
그동안 발목을 잡아온 실적과 불공정거래 의혹도 해소된 상태다. 실적 부문에선 지난 1월 체외진단기기업체 에프에이를 인수해 헬스케어사업부로 흡수한 것이 주효했다. 해당 인수로 지난해 기준 1000억원대 매출을 발생시킨 에프에이의 실적이 에이치엘비 실적에 포함된다.
이 시각 인기 뉴스
에프에이 인수 효과는 1분기 즉각적으로 나타났다. 에이치엘비는 1분기 매출액 634억원, 영업이익 189억원을 기록했다고 잠정공시한 상태다. 매출액은 전년 동기 대비 1052.1% 폭증했고, 영업이익도 흑자로 돌아섰다. 전체 매출의 83.8%를 체외진단 의료기기 사업에서 거둬들였다. 지난해 31.7% 대비 크게 늘어난 비중이다.
이에 따라 2019년부터 지난해까지 3년 연속 영업손실을 기록하며 경고등이 들어온 관리종목 지정 위기 탈피 가능성이 높아졌다. 코스닥 상장기업은 별도기준(지주사는 연결기준) 4년 연속 영업손실 발생 시 관리종목으로 지정된다.
가장 큰 불안요소였던 불공정거래 의혹도 불식됐다. 앞서 진양곤 HLB 회장은 지난 2019년 6월 리보세라닙의 임상 결과가 1차 유효성 지표에 도달하지 못해 신약허가가 쉽지 않을 수 있다고 밝혔다. 하지만 9월 임상학적 유의미성을 충분히 확보해 신약허가를 신청해 볼만하다고 입장을 재차 밝히며 급락했던 주가가 반전됐다. 해당 발표 이후 4만원 중반대였던 HLB 주가는 한달여 만에 18만원을 넘어섰다. 이에 HLB가 실패에 가까운 임상 결과를 성공한 것처럼 자의적으로 해석했다고 보면서 수사가 시작됐다.
자칫 회사 존폐를 가를 수 있는 요소였지만 HLB는 지난 3월15일 사내 게시판 공지를 통해 서울남부지검 금융·증권범죄수사협력단으로부터 무혐의 처분을 공식 확인, 2020년 5월 금융감독원 첫 조사 이후 2년 가까이 진행된 모든 조사가 종결됐다고 밝히며 관련 의혹을 씻어내는데 성공했다.
불확실성을 키우던 요소를 모두 떨쳐낸 HLB는 리보세라닙의 신약승인 신청 준비에 집중한다는 계획이다. 이를 위해 3월 무혐의 처분 확인 이후 미국 식품의약국(FDA) 출신 전문가인 정세호 박사와 장성훈 박사를 각각 신임 대표와 부사장(COO)으로 영입했다. 기존 임상·연구개발 위주에서 신약허가신청(NDA) 준비 체제로 본격적인 전환에 나선다는 계획이다.
여기에 리보세라닙의 또 다른 적응증인 선양낭성암에 대한 임상 2상 결과를 내달 열리는 미국 임상종양학회(ASCO)를 통해 발표한다. 지난 2019년 임상 3상을 마친 위암 3차 치료제로서의 허가신청을 위한 서류 보완작업을 진행 중이다. 내년 1분기까지 3개 암종 중 2개 분야에 대한 신약허가 신청을 제출한다는 목표다. 이밖에 위암 2차 치료제로서의 병용 임상 1·2a상(미국, 한국)과 대장암 3차 치료제 병용 1b·2상(미국) 역시 착수를 위한 준비 중에 있다.
HLB 관계자는 "3개 분야 모두 희귀의약품으로 지정돼 신청 이후 6개월 내 허가 여부가 결정될 수 있을 것으로 보인다"며 "미국 허가 이후 아시아와 유럽 허가도 추진할 예정이며, 직판과 파트너링 등 권역별 판매 효율을 극대화 시킬 수 있는 유통 전략 등을 수립 중"이라고 말했다.
