
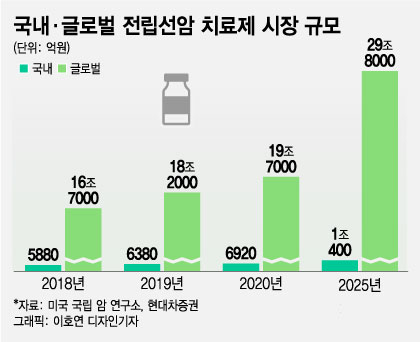
5일 업계에 따르면 FDA는 최근 노바티스 플루빅토를 전이성 거세저항성 전립선암 치료제로 승인했다. 플루빅토는 방사성 의약품으로 방사성 동위원소를 이용해 암 병변을 표적·치료하는 약이다.
플루빅토는 전립선암 환자 95%에서 과하게 발현하는 PSMA(Prostate Specific Membrane Antigen, 전립선특이막항원)라는 단백질을 타깃한다. PSMA는 정상 세포에서는 거의 발현하지 않기 때문에 암을 표적하는 바이오 마커로 사용할 수 있다. 해당 기전으로는 플루빅토가 계열 내 최초 신약(First-in-class)이다.
이번 FDA 승인으로 플루빅토는 전이성 전립선암 표준치료제로 떠오를 것으로 보인다. 플루빅토는 단독 투여 임상에서 기존 화학 치료법 대비 전립선암 환자 전체 생존기간을 15.3개월로 5개월 개선시켰다. 무진행 생존기간도 8.7개월로 5.3개월 증가했다. 종양 크기가 50% 이상 줄어드는 등의 부분 관해를 보인 환자는 41.8%, 암이 더는 진행하지 않는 완전 관해율도 0% 대비 9%라는 결과를 보였다.
국내 기업으로는 퓨쳐켐이 같은 기전과 적응증의 방사성 의약품 FC705를 개발 중이다. 퓨쳐켐은 방사성 의약품 신약 개발 사업을 전문으로 하며 2018년 알츠하이머 치매 진단용 방사성 의약품 '알자뷰'를 30번째 국산 신약으로 허가받은 바 있다.
이 시각 인기 뉴스
경쟁 약물인 플루빅토가 먼저 FDA 승인을 받았지만 덕분에 FC705 성공 가능성도 커졌다. FC705는 임상 1상 중간 결과에서 플루빅토 대비 더 적은 용량으로 높은 효과를 보였다. 지난해 11월 공개된 1상 중간 결과에 따르면 FC705는 플루빅토 절반 용량인 100mCi를 30명 환자에게 투여했으며 이중 환자 1명이 8주 뒤 완전 관해를 보였다는 평가를 받았다. 다른 환자들에게도 부분 관해나 암 크기 늘지 않는 안정 병변이 관찰됐다.
퓨쳐켐 관계자는 "FC705는 플루빅토보다 좀 더 성능을 업그레이드시킨 약"이라며 "같은 작용 기전인 만큼 플루빅토 허가 이후 개발 전망을 밝게 보고 있다"고 말했다.
플루빅토 단점은 화학 치료 요법 대비 상대적으로 높은 부작용이지만 FC705에서는 아직 부작용 이슈가 나오지 않았다. 임상을 완료하고 출시에 성공하면 계열 내 최고 신약(Best-in-class)이 될 가능성도 있다.
FC705는 국내 임상 1상을 진행 중이며 올해 중순 최종 결과를 받아볼 것으로 예상된다. 퓨쳐켐은 지난달 식품의약품안전처에 임상 2상을 신청했다. 임상 시험이 허가되면 서울성모병원에서 20명 환자들에게 1상과 같은 100mCi 용량으로 8주간 약을 투여할 예정이다. 회사 관계자는 "미국 임상 시험도 4월 중 신청할 것으로 예상한다"고 밝혔다.
