특히 글로벌 제약사들뿐만 아니라 국내 업체들도 치매치료제 개발에 속도를 내고 있어 K-치료제가 '난공불락'의 치매에 깃발을 꽂고 전 세계 치매환자와 그 가족들의 희망이 될 수 있다는 전망도 나온다.
업계 관계자는 "치매 환자는 급격하게 늘고 있는데 치료제 임상을 비롯해 개발이 너무 어려웠다"며 "글로벌에서 전무했던 치료제 승인 사례가 등장하면서 국산 치료제 개발도 희망이 보인다"고 했다.

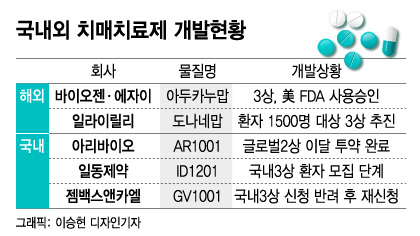
바이오젠은 'EMERGE'와 'ENGAGE'로 명명된 임상3상을 진행해 EMERGE 임상에서 유의미한 결과를 얻었다. 1차 유효성 평가 지표인 임상치매평가척도(CDR-SB)에서 통계적으로 유의미한 개선이 나타났다.
고용량 아두카누맙으로 치료 받은 환자들은 78주 후 임상치매평가척도에서 기준치 대비 임상 증상 악화가 유의하게 감소해 위약군 대비 약 23% 개선됐다. 완치 개념은 아니지만 인지능력 악화 속도를 늦춘다는 효과를 증명했다.
이 시각 인기 뉴스
다만 EMERGE와 ENGAGE는 유사하게 설계됐음에도 한 쪽에서만 유의미한 결과가 나왔다는 한계가 있다. 효과 대비 연간 6000만원의 치료비용도 부담이 크다. FDA는 데이터 불명확성을 이유로 추가 임상과 데이터 제출을 전제조건으로 사용승인을 했다.
미국 일라이릴리가 개발 중인 치매치료제 '도나네맙'의 경우 지난 1월 임상2상 결과가 공개됐다. 아밀로이드베타(Aβ)를 표적으로 한 N3pG라는 항체로 임상2상에서 초기 알츠하이머 환자들의 증상 진행 속도를 32% 늦췄다고 발표했다.
일라이릴리는 지난해 6월부터 새로운 임상2상(TRAILBLAZER-EXT)의 피험자 수를 500명으로 확대해 환자를 모집하다가 1500명을 대상으로 한 임상3상으로 변경했다. 개발 성공에 대한 자신감이 담겼다는 관측이다.
치매치료제 '8부 능선' 넘은 바이오벤처 아리바이오
아리바이오가 지난 3월 공개한 치매치료제 'AR1001'의 임상2상 결과(6개월 투여)에 따르면 환자의 인지능력을 평가하는 1차 유효성 지표(ADAS-Cog 13)에서 저농도 투여군(10mg)과 고농도 투여군(30mg) 모두 인지기능이 향상됐다.
임상2상은 미국에서 210명의 경증·중등증 알츠하이머병 환자들을 대상으로 진행됐다. 다른 알츠하이머 약물 복용없이 30mg을 복용한 환자군은 인지기능이 위약군 대비 1.78점 높아졌고 경증도 환자군은 1.98점 향상됐다.
특히 △단독 복용 △경증도 알츠하이머 △비고도비만(BMI 35 미만) 등 3가지를 충족하는 환자들 중에서는 10mg 투여군에서 2.05점, 30mg 투여군에서 3.68점의 높은 인지기능 향상 효과를 보였다.
 정재준 아리바이오 대표 인터뷰 /사진=김휘선 기자 hwijpg@
정재준 아리바이오 대표 인터뷰 /사진=김휘선 기자 hwijpg@핸드폰을 사용하지 못하던 치매 노인이 6개월 뒤 핸드폰을 사용할 수 있게 됐거나 방을 못 찾아가던 노인이 방을 찾을 수 있게 됐고, 5번 이야기해야 1번 대답할 수 있던 노인이 3번 만에 대답하게 되는 등의 눈에 띄는 효과가 있었다고 정 대표는 전했다.
아리바이오의 치매치료제는 기존 정맥주사형이 아닌 '경구용(알약)'으로 개발돼 고령층이 보다 편리하게 복용할 수 있고, '다중기전 방식'이라는 점에서 단일 기전인 기존 치료제와 비교해 효과를 볼 수 있는 환자군이 넓다는 강점이 있다.
아리바이오는 6개월 투약에 이어 '12개월 투약'을 진행한 임상2상을 이달 말 종료한다. 결과를 분석해 오는 9월 발표한 뒤 미국 FDA에 3상 임상시험계획(IND)을 제출할 예정이다. 3상은 750~1200명 규모의 환자를 모집한다.
임상3상은 미국뿐만 아니라 국내와 유럽에서도 진행된다. 국내 환자는 10~15%, 유럽 35%, 미국에서는 45~50%를 모집할 예정이다. 정 대표는 "임상2상이 사실상 임상3상을 염두에 두고 설계된 만큼 무리 없이 3상에 진입할 것"이라고 전망했다.
