6일 관련업계에 따르면 코아스템 (11,460원 ▼40 -0.35%)의 '뉴로나타-알'의 임상 3상 시험을 진행 중인 가운데 현재까지 23명의 환자 모집이 완료됐다.
코아스템은 당초 '뉴로나타-알' 임상 3상의 마지막 환자 투여 때까지 걸리는 시간을 약 2년으로 예상했다. 이어 모든 투여를 완료한 뒤 약 1년간 임상 데이터를 수집·분석하고 미국 식품의약국(FDA)에 제출할 계획이다.
'뉴로나타-알'의 기술이전을 위한 글로벌 제약사와 협의도 진행 중이다. 지난해 전 세계 코로나19(COVID-19) 확산으로 기술이전 협의가 지연됐다. 또 지난해 11월 루게릭병 줄기세포 치료제 경쟁사라 할 수 있는 브레인스톰의 '뉴로운'(NurOwn) 임상 3상이 실패하면서 글로벌 바이오 시장에서 줄기세포 치료제에 대한 의심의 눈초리가 커진 측면도 있다.
코아스템 관계자는 "'뉴로나타-알'에 대한 기술이전 협의는 여전히 복수의 글로벌 제약사와 이어가고 있다"며 "다만 조금 시간이 필요한 상황"이라고 말했다.
이 시각 인기 뉴스
이어 "'뉴로나타-알'과 관련해 기술이전뿐 아니라 위탁개발생산(CDMO)까지 글로벌 제약사와 함께 논의하고 있다"며 "뉴로운의 임상 3상 실패로 루게릭병 치료제 임상 시험에서 '뉴로나타-알'이 가장 우선 순위에 올라섰다는 의미도 있다"고 덧붙였다.
코아스템 '뉴로나타-알'은 신경계 질환에 대해 처음으로 시판허가 된 줄기세포 치료제다. 2004년 연구를 시작했고, 2014년 7월 식품의약품안전처(식약처)의 의약품 품목허가를 받았다. 2015년 제품을 발매했고, 300명 이상의 국내외 환자에게 투여했다. 이미 치료제로 사용되고 있다.
국내에서 임상 3상을 진행하고, 이 결과를 FDA에서 인정하기로 했다. 한 임상으로 두 나라의 승인을 동시에 받는 국내 바이오 업계 최초 사례다. FDA에서 한국의 임상 시험 역량과 '뉴로나타-알'의 가능성을 높게 평가했단 의미다.
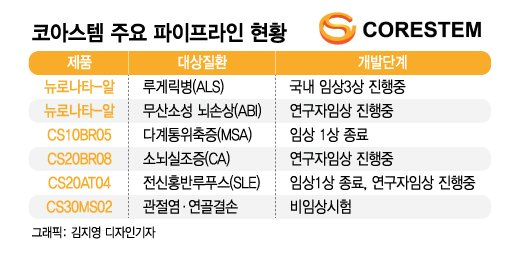
'뉴로나타-알' 외 파이프라인에 대한 연구도 지속하고 있다. 코아스템은 '뉴로나타-알'을 포함해 신경계 질환 4개, 자가면역질환 1개, 근골결계질환 1개의 파이프라인을 보유하고 있다.
'뉴로나타-알'을 무산소성 뇌손상(ABI) 분야로 적응증을 확대하고 있는데, 연구자임상 시험을 진행 중이다. 기존 치료제가 없는 질환이다.
또 다계통위축증(MSA), 소뇌실조증(CA), 전신홍반루푸스(SLE), 관절염·연골결손에 대한 치료제를 개발 중이다. 다계통위축증, 소뇌실조증, 전신홍반루푸스 치료제는 임상 1상을 완료했다.
최근엔 시신경 척수염(NMO)을 목표로 개발 중인 줄기세포 치료제를 식약처에 치료 목적 사용으로 승인 신청했다. 식약처 승인을 받을 경우 서울대학교 병원에서 치료 효과를 확인할 예정이다.
코아스템 관계자는 "'뉴로나타-알'의 임상 3상에서 좋은 성과를 내기 위해 최선을 다하고 있다"며 "코아스템은 '뉴로나타-알'뿐 아니라 다양한 치료제 파이프라인을 보유한 회사로, 루게릭병을 비롯해 파킨슨병, 심장질환, 뇌손상 등 다양한 난치성 희귀질환에 대한 치료제를 개발하고 있다"고 말했다.
