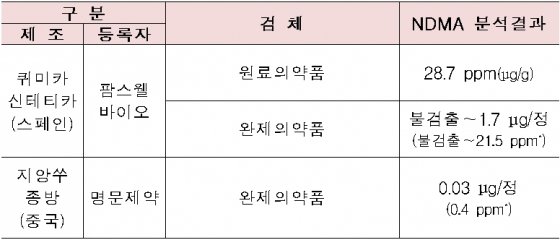
 발사르탄 관련 추가 검사 결과. /자료=식품의약품안전처
발사르탄 관련 추가 검사 결과. /자료=식품의약품안전처식품의약품안전처는 이달 6일 41개 품목에 대한 중간조사 결과 발표 이후 나머지 발사르탄 원료의약품 45개 품목을 수거·검사한 결과, 2개 품목에서 NDMA 기준을 초과한 것으로 확인됐다고 23일 밝혔다.
식약처는 중국 제지앙 화하이사 발사르탄에서 NDMA가 검출된 이후 국내에 수입 또는 제조되는 모든 발사르탄 원료의약품(52개사, 86품목)에 대해 수거·검사를 실시했다.
팜스웰바이오 발사르탄을 사용한 5개 완제의약품은 지난 7월7일 이미 판매중지 조치가 이뤄져 명문제약 '발사닌정80mg' 제품만 추가로 판매중지 및 처방제한 조치를 받는다. 현재 발사닌정80mg 제품을 복용 중인 환자 수는 총 4048명(8월23일 기준), 처방·조제 의료기관은 805개소(병원 311개소, 약국 494개소)인 것으로 조사됐다.
또 제약사가 발사르탄의 NDMA 기준 적합 여부를 확인한 후 적합한 원료만 사용할 수 있도록 해 안전한 제품만 유통될 수 있도록 조치하기로 했다.
